Главный комплекс гистосовместимости hla. Главный комплекс гистосовместимости (MHC): введение
3610 0
Возбудители, такие как бактерии и вирусы, могут проникать в клетки организма и заражать их. При этом Т-клетки организуют иммунный ответ против клеток, содержащих проникший микроорганизм. Как Т-клеткам удается распознавать инфицированные клетки и вообще присутствие любого чужеродного белка-антигена в клетках организма-хозяина?
Если сказать кратко, в настоящее время известно, что белки внутри клетки разделяются на более мелкие фрагменты - пептиды. Некоторые из них ассоциируются с молекулами МНС I или II класса, а образовавшийся комплекс перемещается на поверхность клетки, где может быть распознан Т-клеткой с соответствующим рецептором. В присутствии усиливающих сигналов Т-клетка активируется и инициирует иммунный ответ на распознанный антиген.
Все события, которые сопровождают образование пептидов из белка внутри клетки, связывание пептидов с молекулами МНС, представление комплексов МНС - пептид на поверхности клетки для распознавания Т-клетками, в целом называют процессингом и презентацией антигена В этом феномене молекулы МНС играют ключевую роль, и поэтому, как уже было отмечано ранее, говорят о МНС-рестрикции Т-клеточного ответа. Функции молекул МНС I и II классов в Т-клеточном ответе, однако, различны.
У всех исследованных видов позвоночных функция молекул МНС I класса состоит в презентации пептидов, полученных из белковых антигенов, CD8+-Т-клеткам. По этой причине принято говорить, что СD8+-Т-клетки подвергаются МНС-рестрикции I класса. В отличие от них основная функция молекул МНС II класса - представление антигенов CD4+-T-клеткам, поэтому они подвергаются МНС-рестрикции II класса.
Как пептиды, полученные из белковых антигенов, связываются с молекулами МНС? Далее описано, как процессинг двух разных групп белковых антигенов: экзогенных и эндогенных, приводит к связыванию пептидов с молекулами МНС I или II класса и как образование такого комплекса активирует разные группы Т-клеток.
Ответы на экзогенные антигены: образование комплексов молекула МНС II класса - пептид
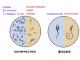
Как следует из названия, экзогенными являются антигены, захваченные внутрь клетки обычно путем эндоцитоза или фагоцитоза. Экзогенные антигены являются фрагментами патогенных микроорганизмов (например, бактерий и вирусов) или чужеродных белков (например, белка куриного яйца или эритроцитов барана), которые хотя и не вредят организму-хозяину, активируют иммунный ответ. Особенно важны ответы на экзогенные антигены, захватываемые АПК - дендритными клетками, В-лимфоцитами или макрофагами.На рис. 9.5 показаны процессинг и презентация типичного экзогенного антигена - белка, введенного в качестве компонента инактивированной или «мертвой» вирусной вакцины. Попадая внутрь клетки, белок оказывается во внутриклеточной вакуоли, которая впоследствии сливается с существующими эндосомами или лизосомальными вакуолями. Эндосомы и лизосомы обладают очень кислой средой (рН около 4) и содержат целый ряд разрушительных ферментов, включая протеазы и пептидазы. Предполагается, что также протеазы, как катепсины, которые действуют в кислой среде, вовлечены в избирательное разрезание белков в этих вакуолях.
На рис. 9.5 также изображено, что закисленные вакуоли, содержащие фрагменты белков, встречаются внутри клетки с вакуолями, которые содержат вновь синтезированные молекулы МНС II класса. Цепи α и β молекулы МНС II класса синтезируются на рибосомах шероховатого эндоплазматического ретикулума. Внутри него эти цепи связываются с молекулой CD74 - инвариантной цепью (Ii). Одна из областей CD74 взаимодействует с полостью только что синтезированной молекулы МНС II класса, предотвращая связывание с пептидами, которые могут находиться в эндоплазматическом ретикулуме. (Это может запустить процессинг эндогенных антигенов, описанный в следующем подразделе.)
Молекула CD74 выступает также в роли «шаперона» для вновь синтезированных цепей МНС II класса: взаимодействие с CD74 позволяет α-и β-цепям покинуть эндоплазматический ретикулум и попасть в комплекс Гольджи, а оттуда включиться в формирование эндоцитозных вакуолей с кислой средой. В кислой среде вакуолей CD74 удаляется из молекулярного комплекса. Вначале CD74 разрушается протеолитическими ферментами, и от него остается только фрагмент CLIP, связанный с полостью молекулы МНС II класса.
Затем вакуоли, содержащие молекулы МНС II класса, связанные с СLIР, сплавляются с вакуолями, обладающими кислой средой (эндосомами/лизосомами), которые содержат пептиды, полученные в ходе катаболизма экзогенных антигенов. В этих образованиях молекула, которую называют HLA-DM, облегчает замену пептида в комплексе молекула МНС II класса - CLIP на пептиды, образовавшиеся из экзогенного антигена. Так формируется комплекс молекула МНС II класса- пептид, который перемещается к поверхности клетки, где он может взаимодействовать с CD4+-Т-клетками, экспрессирующими рецептор, соответствующий антигену.
Рис. 9.5. Образование комплексов антигенных пептидов экзогенного происхождения с молекулами МНС II класса: N инвариантная цепь; CLIP - фрагмент CD74, который связывается с полостью молекулы МНС II класса
Катаболизм типичного белкового антигена приводит к образованию нескольких пептидов (на рис. 9.5 показаны только три). На рис. 9.6 показано, что связывание молекулы МНС II класса и пептидов, прошедших процессинг, является селективным: отдельный пептид связывается с высокой аффинностью с несколькими, но не со всеми молекулами МНС. Эта селективность основана на силе взаимодействия между аминокислотами в составе полости, связывающей белки, в молекуле МНС и аминокислотами в составе пептидов, появившихся в результате процессинга.
На рис. 9.6 пептид 35-48 (числа обозначают позиции аминокислот в белковой последовательности) предпочтительно связывается с HLA-DR4, а пептид 110-122 - с HLA-DP2 у человека, организм которого экспрессирует эти молекулы. Поэтому мы можем назвать пептиды 35-48 и 110-122 иммунодоминантными Т-клеточными эпитопами обсуждаемого белка у данного человека, поскольку они связываются с молекулами МНС, презентируются и активируют СD4+-Т-клетки.

Рис. 9.6. Избирательное связывание процессированных пептидов различными аллелями МНС II класса. Числа соответствуют позициям аминокислот в последовательности белкового антигена
Процессинг эндогенных антигенов происходит скорее в цитоплазме, нежели в вакуолях с кислой средой, в которых обрабатываются экзогенные антигены. Главный механизм образования пептидных фрагментов в цитоплазме связан с прохождением белка через гигантский белковый комплекс - протеазому. Этот комплекс раскалывает белок на пептиды длиной около 15 аминокислот. Цитозольные ферменты (аминопептидазы) удаляют из пептидов еще больше аминокислот. Некоторые пептиды разрушаются, но некоторые (длиной 8-15 аминокислот) избирательно транспортируются в эндоплазматический ретикулум пептидным транспортером, продуктом двух генов, ТАР-1 и ТАР-2.

Рис. 9.7. Процессинг эндогенного антигена с участием молекул МНС I класса: β2m -β2-микроглобулин
В эндоплазматическом ретикулуме пептиды, транспортированные из цитозоля, связываются с вновь синтезированными молекулами МНС 1 класса: рис. 9.7 также показывает, что молекулы МНС I класса и цепи β2-микроглобулина отдельно синтезируются в эндоплазматическом ретикулуме и здесь же объединяются. Так же, как и в случае вновь синтезированных молекул МНС II класса, стабилизировать структуру собранных в эндоплазматическом ретикулуме молекул МНС I класса и цепей β2-микроглобулина и направить комплекс пептид - МНС I класса - β2-микроглобулин сквозь клетку помогают дополнительные белки. Наиболее изученными дополнительными белками, уникальными для транспортировки МНС I класса в эндоплазматический ретикулум, являются тапазин и шаперон калретикулин.
Молекулы МНС I класса предпочтительно связывают пептиды длиной 8-9 аминокислот, т.е. более короткие, чем те, что связываются с молекулами МНС II класса, поскольку полость в связующем участке закрыта с обоих концов. Результаты недавних исследований показали, что обычно пептиды, достигающие эндоплазматического ретикулума, разрушаются аминопептидазами, которые отрезают одну аминокислоту за другой до полного разрушения пептида. «Спасаются» только пептиды длиной 8-9 аминокислот, если связываются с вновь синтезированной молекулой МНС I класса.
Как и в случае взаимодействия пептид - МНС II класса, связывание пептидов с молекулами МНС I класса селективно и определяется последовательностью и структурой пептида и связующей полости МНС I класса. Пептид, связывающийся с молекулой МНС I класса в эндоплазматическом ретикулуме, проходит через комплекс Гольджи к клеточной поверхности, где презенти-руется СD8+-Т-клеткам, экспрессирующим соответствующий антигенный рецептор.
Другие пути процессинга и презентации антигенов
В предыдущих подразделах было описано, как пептиды из эндогенных и экзогенных антигенов взаимодействуют с вновь синтезированными молекулами МНС I и II классов на пути их следования к клеточной поверхности. Данные также наводят на мысль, что пептиды могут связываться с некоторыми молекулами МНС на клеточной поверхности или с молекулами МНС, не содержащими пептиды, или за счет вытеснения прежде связанных пептидов. Пептиды могут также пересекаться с молекулами МНС, которые уже были экспрессированы на поверхности клеток и затем рециркулировали с поверхности назад в клетку.Таблица 9.1. Сравнение свойств и функций молекул МНС I и II классов

Такие АПК, как дендритные клетки и макрофаги, также имеют уникальный путь для образования пептидов, презентируемых СD8+-Т-клеткам, - перекрестное примирование. Эти АПК могут захватывать экзогенные белковые антигены и обрабатывать их по пути МНС I класса (в дополнение к пути МНС II класса). Предполагается, что этот путь играет важную роль в активации CD8+-T-клеток в ответах на инфицированные вирусом клетки и некоторые опухоли.
В табл. 9.1 сравниваются свойства молекул МНС I и II классов и роль этих молекул в обработке (процессинге) и презентации антигенов.
Какие антигены запускают ответ каких Т-клеток?
Уже было рассказано, как экзогенные белковые антигены захватываются АПК, перерабатываются в органеллах с кислым содержимым, которые пересекаются с молекулами МНС II класса, перемещающимися своим путем, и активируют CD4+-Т-клетки. Можно сказать, что почти все без исключения белки бактерий, вирусов, аллергены (белки, запускающие аллергический ответ) или полностью безвредные антигены запускают ответ СD4+-Т-клеток. Также было рассмотрено, как из белков, извлеченных из возбудителей, инфицировавших клетки, - бактерий и вирусов, создаются эпитопы (по эндогенному пути или путем перекрестного примирования), которые презентируются СD8+-Т-клеткам. Таким образом, белки, извлекаемые из этих инфекционных агентов, активируют CD4+- и СD8+-Т-клетки.Заметим, что пути процессинга в большей степени, чем свойства антигенов, определяют, представляется ли белок CD4+- или СD8+-Т-клеткам. Это положение хорошо иллюстрирует перекрестное примирование, при котором экзогенный антиген перерабатывается по пути МНС I класса и презентируется СD8+-Т-клеткам. Антигены, которые введены в цитоплазму, могут создавать пептиды для представления СD8+-Т-клеткам; этот подход может быть полезен для создания ответов на опухолевые антигены.

Рис. 9.8. Распознавание различных антигенов TCR. (А) Суперантиген связывается с Vβ. (Б) Презентация гликолипида молекулой CD1
Суперантигены - это другая категория белковых антигенов. У человека к ним в первую очередь относятся бактериальные токсины, такие как стафилококковый энтеротоксин. У мыши суперантигенами могут быть также продукты некоторых вирусов. Суперантигены связываются с молекулами МНС II класса без предварительного процессинга, но, как показано на рис. 9.8, А, бактериальные суперантигены связываются с участком молекулы МНС II класса вне связывающей пептид полости.
На рис. 9.8, А также показано, что суперантигены связываются с Vβ-областью TCR независимо от экспрессируемой Vα-области. Характерно, что суперантигены связываются с частью Vβ-участка TCR, кодируемого в зародышевой линии, а не с его частью, которая формируется при реаранжировке V-, D- или J-сегментов β-цепи TCR. Таким образом, поскольку существует только около 25 эмбриональных генов Vβ и каждый суперантиген связывает от одной до нескольких эмбриональных последовательностей Vβ, то суперантиген может активировать большое количество Т-клеток организма - до 10 %, что намного больше, чем обычные антигены.
Распознавание липидов
За последние 10 лет выяснилось, что Т-клетки могут распознавать липиды и гликолипиды так же хорошо, как антигены, извлеченные из белков. Т-клеточный ответ на липидные и гликолипидные продукты клеточной стенки, извлеченные из микобактерий, хорошо известен. На рис. 9.8, Б показано, что гены и продукты семейства, названного CD1, участвуют в презентации этих липидов и гликолипидов. Молекулы CD1 имеют отдаленное родство с семейством молекул МНС I и II классов, и предполагают, что они составляют третье семейство антигенпрезентирующих молекул, обеспечивающих презентацию Т-клеткам липидных и гликолипидных антигенов, извлеченных из микробных возбудителей.Молекулы CD1 являются неполиморфными гликопротеинами клеточной поверхности, не относящимися к семейству МНС. Они экспрессируются в ассоциации с β2-микроглобулинами на таких АПК, как дендритные и В-клетки. Соединение липидных антигенов с CD1, как предполагают, происходит в клеточных везикулах с кислым содержимым, так же как и при погружении экзогенных пептидов в молекулы МНС II класса. На рис. 9.8, Б показано, что структура кристаллизованных молекул CD1 сходна со структурой молекул МНС I класса, но у CD1 есть больший связывающий участок с глубокой полостью.
Полость, вероятно, связывает гидрофобную основу липидного антигена; поляризованный участок липида или гликолипида помещается в желобок для связывания с Т-клеточным рецептором. Было показано, что разные представители семейства CD1 представляют антигены γδ+- и αβ+-Т-клеткам и субпопуляции αβ+-Т-клеток, называемой 1МК1.1-СD4-Т-клетки. т.е. клеткам, которые экспрессируют одновременно поверхностные молекулы натуральных киллеров и Т-клеток.
Связывание молекулами МНС пептидов, полученных из собственных молекул
Теперь известно, что феномены процессинга и презентации антигенов являются компонентами нормальной физиологической жизнедеятельности клетки. Другими словами, белки, которые обычно находятся внутри клетки, - собственные белки - превращаются и метаболизируются тем же путем. Например, рибосомальные или митохондриальные белки разрушаются внутри клетки и пептиды, получившиеся из этих молекул, связываются с молекулами МНС. Действительно, молекулы МНС, экстрагированные из клеток, почти всегда содержат пептиды, выделенные из таких собственных белков.Однако собственные пептиды, связанные с молекулами МНС, обычно не активируют Т-клетки; одна из причин этого состоит в том, что Т-клетки, реактивные к собственным молекулам, удаляются или инактивируются в ходе дифференцировки в тимусе. Тем не менее известно, что зрелые Т-клетки, потенциально способные реагировать с собственными молекулами, можно обнаружить за пределами тимуса.
Почему эти Т-клетки не активируются? Учитывая, что клетки организма буквально купаются в море собственных белков, которые они постоянно процессируют и связывают с молекулами МНС, не менее важно узнать, как человеку удается отвечать на крошечные количества чужеродных белков. Это принципиально важные вопросы, поскольку Т-клетка должна быть способна выделить среди множества нормальных клеток собственного организма, на которые не требуется вызвать иммунный ответ, клетку, инфицированную возбудителем, на который необходимо развить иммунный ответ, чтобы его уничтожить.
Вероятно, ответ на эти вопросы заключается в том, что для активации иммунного ответа патогенные микроорганизмы используют дополнительные более выраженные эффекты, чем те, что обеспечивают активацию лимфоцитов только при взаимодействии с выделенным пептидом, связанным с молекулами МНС. Главный эффект, который вызывают возбудители, заключается в индукции костимуляторной функции, также называемой вторыми сигналами, в специализированных клетках, которые представляют антиген Т-клеткам. Костимуляторные сигналы необходимы для активации наивных Т-клеток (т.е. никогда ранее не встречавшихся с антигеном).
В отличие от патогенов пептиды, полученные из собственных белков, обычно взаимодействуют с Т-клетками на клетках нормальной ткани (например, печени или селезенки), которые не экспрессируют сигналов с костимуляторной функцией; в этом случае Т-клетки не активируются. Даже если пептиды, полученные из собственной молекулы, презентируются АПК в ткани, Т-клетки не активируются. Это происходит благодаря тому, что АПК в тканях обычно не экспрессируют костимуляторных сигналов в отсутствие чужеродного антигена или воспалительного ответа. Эта необходимость в дополнительных сигналах и наличии комплексов МНС-пептид означает, что Т-клетки не будут отвечать на собственные компоненты, а будут отвечать на чужеродные потенциально опасные антигены.
Некоторые ученые предполагали, что экспозиция чужеродного антигена может индуцировать повреждение ткани («гипотеза опасности») и что сигналы опасности, генерируемые таким образом, активируют Т-клетки. Эту гипотезу предложили, чтобы объяснить, почему Т-клетки отвечают на чужеродные белки и не отвечают на собственные. Согласно гипотезе собственные белки не образуют сигналов опасности. Для оценки и подтверждения этой гипотезы необходимы дальнейшие исследования.
Неспособность отвечать на антиген
Как уже описано в предыдущих подразделах, на клетках любого организма экспрессируется небольшое число разных молекул (антигенов) МНС I класса (6) и II класса (обычно от 10 до 20 у людей; 6 у мышей). Для того чтобы развить Т-клеточный ответ, хотя бы один пептид, полученный в результате процессинга, должен связаться с одной из этих молекул МНС. Пептид, который не делает этого, не вызывает Т-клеточного ответа. Поэтому вполне вероятно, что некоторые организмы будут отвечать на небольшой пептид, а другие особи, отличные по антигенам МНС, не будут. Подобная ситуация может возникнуть, если нескольким людям инъецируют белковую вакцину; кто-то сформирует на нее ответ, а кто-то - нет.Если из целого антигена не удается выделить ни одного пептида, способного связаться с молекулой МНС, то в таком организме Т-клеточный ответ на этот конкретный антиген не разовьется. Этот тип нечувствительности к целому антигену может возникнуть, например, при ответе на синтетические полимеры аминокислот, которые содержат очень небольшое количество эпитопов. У патогенных микроорганизмов обычно множество эпитопов, поэтому неспособность к ответу на естественные (природные) патогены встречается крайне редко.
Различия в молекулах МНС: связь МНС с устойчивостью или восприимчивостью к заболеваниям
Полиморфизм является серьезным препятствием для приживления ткани, трансплантированной от одного организма к другому, поскольку очень маловероятно, что два случайных индивидуума будут генетически идентичны. Поскольку почти каждый вид позвоночных вырабатывает подобные различные наборы генов и молекул МНС, поддержание разнообразия МНС должно иметь какое-то биологическое преимущество для вида в целом.Считается, что поддержание разнообразия молекул МНС является важным механизмом, который используют человек и животные, чтобы защитить себя от массы патогенных организмов. Чтобы проиллюстрировать это положение, представим ситуацию, при которой в популяции существует только одна молекула МНС, а вновь возникший возбудитель не продуцирует эпитоп, способный с ней связаться. В этом крайнем случае Т-клеточный ответ не будет активирован, и может исчезнуть целый вид. Таким образом, поддержание большого числа генов и молекул МНС в пределах вида значительно снижает риск такого негативного эффекта от одного возбудителя.
Пример того, как разнообразие аллелей МНС может влиять на прогрессирование заболевания, был получен при исследовании пациентов, инфицированных ВИЧ-1. У индивидуумов, гетерозиготных (т.е. экспрессирующих разные продукты с отцовской и материнской хромосом) по одному или более локусу HLA I класса, СПИД развивался позднее, чем у гомозиготных (экспрессирующих одинаковые продукты с генов обеих хромосом) индивидуумов. Одним из возможных объяснений этого является то что гетерозиготы по HLA могут презентировать своим Т-клеткам более широкий спектр пептидов, полученных от возбудителей, чем гомозиготы, и поэтому у них более вероятно развитие какого-либо типа защитного ответа.
В последние годы стало понятно, что экспрессия определенного аллеля МНС является одним из важнейших факторов, определяющих восприимчивость или устойчивость к различным инфекционным агентам. У людей экспрессию специфических аллелей HLA связывают с чувствительностью или устойчивостью к нескольким возбудителям разных инфекционных заболеваний, таким как Т-лимфотропный вирус человека первого типа (HTLV-1), вирус гепатита В, возбудители лепры, малярии, туберкулеза, а также склонностью к быстрому прогрессированию СПИДа.
Подобные связи восприимчивости и резистентности с МНС были показаны и для других видов, в частности болезнь Марека (вирусное заболевание кур) и вирус бычьего лейкоза у коров. Практически для всех известных примеров болезней или состояний, связанных с определенным аллелем МНС, точные механизмы, связывающие обладание геном с началом или прогрессированием заболевания, пока не определены. У пациентов с определенными аллелями HLA существует больший риск развития определенных аутоиммунных или воспалительных болезней.
Другие гены области МНС
Картирование областей МНС у людей и мышей показало, что они содержат намного больше генов (и псевдогенов), чем зоны кодирования полиморфных молекул МНС I и II классов, описанные в этой главе. Область МНС между генами I и II классов содержит гены МНС III класса, которые кодируют компоненты сывороточной системы комплемента С2, С4 и фактор В. У людей эта область также содержит и несколько различных генов: два цитокина (факторы некроза опухоли α и β), два белка теплового шока (hsp 70-1 и 70-2) и 21-гидроксилазу (фермент, участвующий в метаболизме стероидов). Были идентифицированы дополнительные человеческие (HLA-E, F и G) и мышиные гены МНС I класса (Qa и TLa), значительно менее полиморфные, чем гены I класса.Функция продуктов большинства этих генов в настоящее время не очень понятна, но они могут участвовать в презентации антигенов для Т-клеток. Предполагается, что экспрессия HLA-G клетками трофобласта плаценты является одним из механизмов, предотвращающих отторжение плода организмом матери.
Область МНС II класса также содержит не только гены, кодирующие молекулы клеточной поверхности, которые описаны в этой главе. В частности, это гены HLA-DM и HLA-DO в области II класса у человека (М и О у мышей). Как было описано ранее, HLA-DM катализирует замену пептидов (CLIP, который образуется из инвариантной цепи) на пептид из чужеродного белка. Ген HLA-DO экспрессируется только в В-лимфоцитах и эпителиальных клетках тимуса; белок работает как отрицательный регулятор пептидного обмена, опосредованного HLA-DM.
Гены, которые кодируют молекулы, вовлеченные в путь презентации антигена с участием МНС I класса, - белковые транспортные молекулы ТАР-1 и ТАР-2 и главные субъединицы протеазомы LMP-2 и LMP-7, - также находятся в области МНС II класса. Почему все эти гены объединены в комплекс, который передается по наследству в единстве с генами, кодирующими основные молекулы межклеточных взаимодействий, в настоящее время науке неизвестно.
Выводы
1. Молекулы МНС играют ключевую роль в ответе Т-клеток на антигены, которые проникают в клетки организма или живут в них. Эти молекулы связывают пептиды, полученные из антигенных белков, и презентируют их Т-клеткам с соответствующим рецептором. Поэтому говорят о МНС-рестрикции Т-клеточного ответа2. Область МНС кодирует две большие группы трансмембранных поверхностных клеточных молекул - I и II классы. Молекулы МНС I класса экспрессируются на всех ядросодержащих клетках. Молекулы МНС II класса экспрессируются конститутивно только на АПК, таких как В-клетки или дендритные клетки. Экспрессию молекул МНС II класса можно индуцировать на клетках многих типов, особенно в ответ на цитокины, которые выделяются при ответе на инфекционные агенты.
3. Каждый индивидуум экспрессирует набор разных молекул МНС I и II классов. Эти различия появляются из-за того, что у конкретных организмов внутри вида встречаются множество слегка отличающихся форм (аллелей) генов МНС обоих классов (генетический полиморфизм). Благодаря выраженному полиморфизму каждый человек обладает почти уникальным набором наследуемых генов МНС.
4. Внутри одного организма молекулы МНС I и II классов одинаковы на всех клетках; их экспрессия на клеточной поверхности кодоминантна (т.е. присутствуют продукты как с материнской, так и с отцовской хромосомы).
5. На внешней области каждой молекулы МНС I и II классов находится глубокая бороздка (полость), которая связывает пептиды, полученные в результате катаболизма (процессинга) белковых антигенов. Пептиды с молекулами МНС связываются селективно. Каждая молекула МНС связывает свой набор пептидов с определенным мотивом.
6. Экзогенные белковые антигены захватываются внутрь АПК и процессируются до пептидов в вакуолях с кислой средой, где взаимодействуют с молекулами МНС II класса. Комплекс пептид - молекула МНС II класса транспортируется на поверхность клетки, где взаимодействует с TCR, экспрессируемым СD4+-Т-клеткой. Говорят о рестрикции ответа CD4+-T-клеток молекулами МНС II класса (собственными молекулами МНС II класса).
7. Эндогенные белковые антигены, в основном принадлежащие инфекционным патогенам, проникают внутрь клетки и процессируются до пептидов в цитозоле. Пептиды, полученные из этих белков, взаимодействуют с молекулами МНС I класса внутри эндоплазматического ретикулума. Комплекс пептид-молекула МНС I класса транспортируется на поверхность клетки, где взаимодействует с TCR, экспрессируемым CD8+-T-клеткой. Говорят о рестрикции ответа СD8+-Т-клеток молекулами МНС I класса (собственными молекулами МНС I класса).
8. Поскольку белки являются достаточно сложными структурами, обычно образуется хотя бы один пептид, способный связаться с молекулой МНС, что обеспечивает Т-клеточный ответ по меньшей мере на какую-то часть чужеродного антигена.
9. Молекулы МНС связывают пептиды, полученные из собственных белков, так же как и от чужеродных антигенов, но комплексы молекул МНС с собственными пептидами в нормальных условиях не активируют Т-клеточный ответ. Это связано с тем, что обычно собственные молекулы не генерируют костимуляторные (вторые) сигналы, необходимые для активации наивных Т-клеток. Т-клеточный ответ сфокусирован на противодействии чужеродным (несобственным) молекулам, в частности компонентам микроорганизмов, которые запускают костимуляторные функции.
10. Восприимчивость или устойчивость к большинству болезней у людей и других видов связана с экспрессией определенного аллеля МНС.
Р.Койко, Д.Саншайн, Э.Бенджамини
ГЛАВНЫЙ КОМПЛЕКС ГИСТОСОВМЕСТИМОСТИ (ГКГ), комплекс генов, кодирующих белки, ответственные за представление (презентацию) антигенов (смотри Антигенпредставляющие клетки) Т-лимфоцитам при иммунном ответе. Первоначально продукты этих генов были идентифицированы как антигены, обусловливающие совместимость тканей, что и определило название комплекса (от английского major histocompatibility complex). У человека антигены ГКГ (и сам комплекс) называются HLA (от английского human leukocyte antigens), так как изначально они были обнаружены на лейкоцитах. Комплекс HLA локализуется в 6-й хромосоме и включает более 200 генов, разделённых на 3 класса. Деление на классы обусловлено особенностями структуры кодируемых ими белков и характером вызываемых иммунных процессов. Среди генов первых двух классов имеются так называемые классические гены, для которых характерен чрезвычайно высокий полиморфизм: каждый ген представлен сотнями аллельных форм. К классическим генам ГКГ человека относятся HLA-гены А, В, С (класс I), гены DR, DP и DQ (класс II). Гены ГКГ класса III кодируют белки, не имеющие отношения к гистосовместимости и презентации антигена. Они контролируют образование факторов системы комплемента, некоторых цитокинов, белков теплового шока.
Конечные продукты генов ГКГ представлены гликопротеинами, которые встраиваются в мембрану клеток. Гликопротеины ГКГ класса I присутствуют в клеточных мембранах практически всех ядросодержащих клеток, а гликопротеины класса II - только в антигенпрезентирующих клетках (дендритные клетки, макрофаги, В-лимфоциты, некоторые активированные клетки). В процессе образования гликопротеинов ГКГ класса I в их состав встраиваются образующиеся в ходе протеолиза фрагменты внутриклеточных белков, а в случае класса II - белков межклеточного пространства, поглощаемых клеткой. Среди них могут оказаться компоненты патогенных микроорганизмов. В составе гликопротеинов ГКГ они выносятся на поверхность клетки и распознаются Т-лимфоцитами. Этот процесс называется презентацией антигена: чужеродные антигенные пептиды представляются цитотоксическими Т-клеткам в составе гликопротеинов ГКГ класса I, Т-хелперам - в составе гликопротеинов ГКГ класса II.
Продукты различных аллельных форм генов ГКГ отличаются по сродству к различным пептидам. От того, какие аллели генов ГКГ присутствуют в данном организме, зависит эффективность защиты от того или иного патогена. Она определяется связыванием чужеродных пептидов с гликопротеинами ГКГ класса II, так как их презентация Т-хелперам лежит в основе всех форм иммунного ответа. В связи с этим гены ГКГ класса II рассматриваются в качестве генов иммунного ответа (генов Ir).
В определённых ситуациях иммунный ответ может быть вызван в результате презентации пептидных фрагментов собственных белков организма в составе молекул ГКГ класса II. Следствием этого может быть развитие аутоиммунных процессов, которое, таким образом, также находится под контролем генов ГКГ класса II.
Определение классических генов ГКГ (ДНК-типирование) осуществляется с помощью полимеразной цепной реакции при пересадке органов и тканей (для подбора совместимых пар донор - реципиент), в судебно-медицинской практике (для отрицания отцовства, идентификации преступников и жертв), а также в геногеографических исследованиях (для изучения родственных связей и миграции народов и этносов). Смотри также Иммунитет.
Лит.: Ярилин А. А. Основы иммунологии. М., 1999; Devitt Н. О. Discovering the role of the major histocompatibility complex in the immune response // Annual Review of Immunology. 2000. Vol. 18; Хаитов Р. М., Алексеев Л. П. Физиологическая роль главного комплекса гистосовместимости человека // Иммунология. 2001. №3.
Главный комплекс гистосовместимости - это группа генов и кодируемых ими антигенов клеточной поверхности, которые играют важнейшую роль в распознавании чужеродного и развитии иммунного ответа. HLA - человеческие лимфоцитарные антигены MHC. HLA были открыты в 1952 г. при изучении антигенов лейкоцитов. Антигены HLA представляют собой гликопротеиды, находящиеся на поверхности клеток и кодируемые группой тесно сцепленных генов 6-й хромосомы . Антигены HLA играют важнейшую роль в регуляции иммунного ответа на чужеродные антигены и сами являются сильными антигенами.
Антигены HLA подразделяются на антигены класса I и антигены класса II . Антигены HLA класса I необходимы для распознавания трансформированных клеток цитотоксическими Т-лимфоцитами .
Открытие MHC произошло при исследовании вопросов внутривидовой пересадки тканей. Генетические локусы, ответственные за отторжение чужеродных тканей, образуют в хромосоме область, названную главным комплексом гистосовместимости (MHC) (англ. major histocompatibility complex).
Затем, первоначально в гипотетической, на основании клеточной феноменологии, а затем в экспериментально хорошо документированной форме с использованием методов молекулярной биологии было установлено, что Т-клеточный рецептор распознает не собственно чужеродный антиген , а его комплекс с молекулами, контролируемыми генами главного комплекса гистосовместимости. При этом и молекула MHC и фрагмент антигена контактируют с ТКР.
MHC кодирует два набора высокополиморфных клеточных белков, названных молекулами MHC класса I и класса II. Молекулы класса I способны связывать пептиды из 8-9 аминокислотных остатков, молекулы класса II - несколько более длинные.
Высокий полиморфизм молекул MHC, а также способность каждой антигенпрезентирующей клетки (АПК) экспрессировать несколько разных молекул MHC обеспечивают возможность презентации T-клеткам множества самых различных антигенных пептидов.
Следует отметить, что хотя молекулы MHC и называются обычно антигенами, они проявляют антигенность только в том случае, когда распознаются иммунной системой не собственного, а генетически иного организма, например, при аллотрансплантации органов.
Наличие в МНС генов, большинство из которых кодирует иммунологически значимые полипептиды, заставляет думать, что этот комплекс эволюционно возник и развивался специально для осуществления иммунных форм защиты.
Существуют еще и молекулы MHC класса III , но молекулы MHC класса I и молекулы MHC класса II являются наиболее важными в иммунологическом смысле.
Так называемые лейкоцитарные Аг HLA (произносят как «эйч эль эй», от «Human Leukocyte Antigens») - гликопротеины, кодируемые генами главного комплекса гистосовместимости - MHC (произносят как «эм эйч си», от «Major Histocompatibility Complex») определяют биологическую индивидуальность каждого человека. Эти гликопротеины в иммунной системе выполняют важнейшую функцию: они участвуют в предъявлении антигенпредставляющими клетками (АПК) пептидных Аг T-лимфоцитам.
ГЛАВНЫЙ КОМПЛЕКС ГИСТОСОВМЕСТИМОСТИ
HLA-молекулы, кодируемые генами MHC, подразделяют на гликопротеины MHC класса I (HLA-A, HLA-B и HLA-C; эти гликопротеины представлены на поверхности всех соматических клеток, исключением являются клетки ворсинчатого трофобласта и эритроциты) и MHC класса II (HLA-DP, HLA-DQ и HLA-DR; экспрессированы преимущественно на мембране АПК - ДК, активированных макрофагов и В-лимфоцитов, а также на T-хелпе- рах; неиммунокомпетентные соматические клетки в нормальных условиях не экспрессируют молекулы MHC-II. Аг-распознающие молекулы T-лимфоцитов (по крайней мере TCRαβ) способны «увидеть» и связать Аг только в комплексе с молекулами MHC-I или MHC-II, в том числе и на поверхности клеток своего организма. Таким образом, природная функция белков MHC - представление пептидных Аг T-лимфоцитам.
Гены комплекса MHC
Комплекс MHC весьма значителен по размеру, включает около 2000 аллельных вариантов генов. Расположение в геноме локусов комплекса MHC человека схематически показано на рис. 7.1.
Рис. 7.1. Расположение генов MHC в хромосоме 6 человека.
MHC-I. Гены групп HLA-A, HLA-B и HLA-C кодируют молекулы MHC класса I.
MHC-II. Гены групп HLA-DP, HLA-DQ и HLA-DR кодируют молекулы MHC класса II.
MHC-III. Термин «MHC-III» обозначает область между MHC-I и MHC-II, здесь картированы гены, кодирующие некоторые компоненты системы комплемента (C4a и C4b, С2, фактора В), цитокинов - (TNF-α и лимфотоксина), 21-гидроксилазы (фермента, участвующего в биосинтезе стероидных гормонов) и др.
Неклассические гены не принадлежат ни к одному из классов MHC. Описано 6 таких генов в области расположения генов MHC-I (Е, F, G, Н, J, X), и 6 - в области MHC-II (DM, DO, CLIP, TAP, LMP, LNA).
Трансмембранные гликопротеины MHC
Молекула MHC-I (см. рис. 5.1A) состоит из двух полипептидных цепей - α- и β2-мик- роглобулина.
α-Цепь состоит примерно из 325 АК-остатков, имеет молекулярную массу около 45 кД (килоДальтон) и содержит 3 внеклеточных домена (α1, α2, α3), трансмембранный участок и цитоплазматический участок из 55 АК-остатков. Домены α1 и α2 формируют углубление в виде желоба или «корзины», составляющего 0,25x0,1x0,11 нм для связывания пептидов Аг длиной 9-11 АК, предназначенного для распознавания T-лимфоцитами.
С внеклеточными α-доменами нековалентно ассоциирована лёгкая полипептидная цепь с молекулярной массой 11,5 кД, называемая β2-микроглобулином (кодируется геном, расположенным вне комплекса MHC, в 15-й хромосоме).
Молекулы MHC-II (см. рис. 5.1Б) - гетеродимеры из двух трансмембранных гликопротеинов: α-цепи (молекулярная масса 34 кД) и β- цепи (молекулярная масса 29 кД). Внеклеточная часть каждой цепи имеет два домена. Пептидсвязывающую щель формируют совместно α1- и β1-домены. В отличие от аналогичного углубления в составе гликопротеинов MHC-I, щель MHC-II открыта с обеих сторон, что позволяет связывать более длинные пептиды (15-30 АК).
Генетический полиморфизм
Гены комплекса MHC (в отличие от генов TCR и иммуноглобулинов) не подвергаются рекомбинации. Механизм их приспособления к неограниченному множеству потенциальных Аг заключается в их генетическом полиморфизме (кодоминантность, множественность аллелей, естественный отбор).
Кодоминантность. Гены MHC кодоминантны, т.е. одновременно экспрессируются гены материнской и отцовской хромосом. Генов MHC-I по 3 (А, В, С) в каждой из гомологичных хромосом, генов MHC-II - также по 3 (DP, DQ, DR); следовательно, если у матери и отца нет одинаковых аллелей, то каждый человек имеет как минимум 12 различных основных аллелей каждого гена MHC классов I и II, вместе взятых.
Множественность аллелей. Полиморфизм классических генов MHC (классов I и II) означает наличие в популяции множества аллелей - вариантов одноимённого гена у разных особей. Для отдельных локусов MHC известно более сотни аллельных вариантов. Каждый аллельный вариант молекулы MHC преимущественно связывает пептиды с определёнными «якорными» АК-остатками.
Эволюционный отбор. Каждая особь потенциально способна развить защитный иммунный ответ только на те пептиды, которые способны связать гликопротеины MHC этой особи. Конкретные варианты MHC закрепляются в эволюции естественным отбором, и каждая отдельная особь оказывается приспособленной к региональным видам и штаммам инфекционных микроорганизмов, на защиту от которых шёл отбор MHC у предков.
Неклассические гены MHC, видимо, не полиморфны или не столь полиморфны, как гены MHC классов I и II.
Комплексы «пептидный Аг-MHC-I» или «пептидный Аг-MHC-II)»
Формирование комплексов пептидных Аг с молекулами MHC раз-
ных классов происходит в различных клеточных компартментах.
MHC-I «обслуживают» зону цитозоля, сообщающегося через ядерные поры с содержимым ядра. Здесь происходит фолдинг (принятие правильной конформации) синтезированных белковых молекул. При возникновении ошибок (в том числе и при синтезе вирусных белков) белковые продукты расщепляются в мультипротеазных комплексах (протеасомы). Образующиеся при этом пептиды связываются с молекулами MHC-I. В результате молекулы MHC-I представляют T-лимфоцитам внутриклеточно образующиеся пептидные Аг. Поэтому CD8+ T-лимфоциты, которые распознают комплексы Аг с MHC-I, участвуют в первую очередь в защите от вирусных, а также внутриклеточных бактериальных инфекций.
MHC-II. Зона «обслуживания» MHC-II связана с внеклеточной средой, а также с клеточными органоидами (аппарат Гольджи, эндоплазматический ретикулум, лизосомы, эндосомы и фагосомы). Пептиды, образующиеся в данной зоне, имеют внеклеточное происхождение - это продукты протеолиза белков, захваченных клеткой посредством эндоцитоза или фагоцитоза. Вновь синтезированные молекулы α- и β-цепей MHC-II с помощью инвариантной полипептидной цепи Ii и кальнексина экспонируются внутрь везикул (эндосом или фаголизосом) и только здесь, связавшись с пептидным Аг, принимают необходимую конформацию для дальнейшей экспрессии на мембране клетки. Таким образом, молекулы MHC-II осуществляют представление Аг при развитии иммунных реакций на внеклеточные инфекции. Главную роль в этих реакциях играют CD4+ T-лимфоциты, распознающие Аг в комплексе с MHC-II.
Суперантигены
В ходе эволюции инфекционные микроорганизмы «научились» синтезировать так называемые суперантигены, которые способны присоединяться к молекулам MHC-II без процессинга в АПК и связываться с V-областью β-цепи TCR. Такое связывание вызывает поликлональную активацию 2-20% периферических CD4 + T-лимфо- цитов, что ведёт, с одной стороны, к общей интоксикации организма, с другой - к быстрой гибели активированных T-лимфоцитов путём апоптоза и, следовательно, к иммунодефициту. Например, клиническая картина пищевых отравлений обусловлена главным образом действием энтеротоксинов стафилококков на T-лимфоциты.
Иммунодефицит при ВИЧ-инфекции также в значительной мере объясняется лимфотоксическим действием суперантигенов ВИЧ.
Антигенпредставляющие молекулы CD1
За пределами MHC имеются гены, кодирующие Аг-представляющие молекулы (например, гены кластера CD1: CD1a, CD1b, CD1c, CD1d, CD1e). Продукты этих генов - гетеродимеры (состоят из α-цепи и β2-микроглобулина), они способны связывать и представлять T-лимфоцитам небелковые Аг (например, миколевую кислоту и липоарабиноманнан оболочки микобактерий). Эти молекулы-гетеродимеры конститутивно экспрессированы на ДК и B-лимфоцитах, а также на тимоцитах и энтероцитах. Аг в комплексе с CD1 распознают Tγδ лимфоциты и цитотоксические Tαβ, TCR которых кодируется сегментом Va24. Их фенотип: либо CD4 - /CD8 - , либо CD8 + .
АНТИГЕНПРЕДСТАВЛЯЮЩИЕ КЛЕТКИ
Молекулы MHC контролируют иммунный ответ. Так, Аг MHC-II участвуют в представлении Аг T-клеткам (рис. 7-2, см. также рис. 7.3) и во взаимодействии T- и B-лимфоцитов. Аг MHC-I и MHC-II связываются поверхностно-клеточными дифференцировочными
маркёрами CD (MHC-I с CD8, MHC-II с CD4).
 Рис. 7.2. Распознавание антигена рецептором T-лимфоцита.
Каждый
Аг MHC состоит их разных цепей - α и β. При помощи рецептора
T-лимфоцита T-клетка распознает Аг, но только находящийся в комплексе с
молекулой MHC. В случае T- хелпера в процессе также участвует CD4,
который свободным концом связывается с молекулой MHC. Распознаваемый
T-клеткой Аг имеет два участка: один взаимодействует с молекулой MHC,
другой (эпитоп) связывается с рецептором T-лимфоцита. Подобный же тип
взаимодействия, но с участием CD8, характерен для процесса распознавания
цитотоксическим T-лимфоцитом Аг, связанного с молекулой MHC класса I.
Рис. 7.2. Распознавание антигена рецептором T-лимфоцита.
Каждый
Аг MHC состоит их разных цепей - α и β. При помощи рецептора
T-лимфоцита T-клетка распознает Аг, но только находящийся в комплексе с
молекулой MHC. В случае T- хелпера в процессе также участвует CD4,
который свободным концом связывается с молекулой MHC. Распознаваемый
T-клеткой Аг имеет два участка: один взаимодействует с молекулой MHC,
другой (эпитоп) связывается с рецептором T-лимфоцита. Подобный же тип
взаимодействия, но с участием CD8, характерен для процесса распознавания
цитотоксическим T-лимфоцитом Аг, связанного с молекулой MHC класса I.
Профессиональные Аг-представляющие клетки. Молекулы MHCII экспрессированы только на определённых клетках, которые называют профессиональными АПК. Таких клеток у человека 3 типа: дендритные клетки костномозгового происхождения (ДК), B- лимфоциты и макрофаги. На их мембранах, помимо молекул MHCII и -I, присутствуют все корецепторные молекулы и цитокины, необходимые для активации T-лимфоцита к иммунному ответу. Эндотелий тоже выполняет функции АПК, но особого предназначения. Вероятно, экспрессия комплексов «пептидные Аг-MHC» на клетках эндотелия является тем специфическим сигналом, который привлекает иммунные лимфоциты из циркулирующей крови в очаг поражения (обеспечивает Аг-специфичный хоминг).
Характеристика разных АПК представлена в табл. 7.1.
Таблица 7.1. Свойства профессиональных антигенпредставляющих клеток
 Дендритные клетки
Дендритные клетки
Из всех клеток, имеющих определение «дендритные» (обозначающее лишь «клетки с отростками»), к профессиональным АПК относят только клетки костномозгового происхождения. Такие клетки широко распространены в организме. Их много в покровных тканях (клетки Лангерганса в коже), лимфоидных органах. Если у B-лимфоцитов и
макрофагов есть и иные (причём главные для них) функции - продукция иммуноглобулинов у B-лимфоцитов, фагоцитоз и «переваривание» у макрофагов, - то у дендритных клеток нет других функций, кроме представления Аг и подачи костимулирующих сигналов к лимфоцитам.
Разновидности ДК. Вероятно, имеется 2 разновидности дендритных
♦ миелоидные (ДК 1) происходят из моноцитов. Их, вероятно, можно рассматривать как разновидность макрофагов, специализирующихся на представлении Аг T-лимфоцитам;
♦ лимфоидные (ДК 2) происходят от общей лимфоидной клеткипредшественницы, из которой развиваются также T- и B-лим- фоциты, NK.
Маркёры предшественников лимфоидных ДК: экспрессия ИЛ-3Rα (варианта Рц для ИЛ-3) и одного из двух иммуноглобулиноподобных Рц - ILT3 + или ILN1 - .
Для ДК 2 характерны маркёры лимфоцитов (CD2, CD5, CD7, мРНК α-цепи пре-TCR).
Эндоцитоз. ДК активно и непрерывно поглощают вещества из окружающей среды. В отсутствие патогена ДК поглощают вещества собственных тканей и представляют этот материал T-лимфоцитам без корецепторного стимула. В результате иммунное воспаление в отношении собственных тканей не развивается и поддерживается состояние иммунологической толерантности.
Активация. ДК активируются при проникновении в организм какого-либо патогена, ДК распознают патоген при помощи TOLL- подобных Рц.
♦ На ДК 1 (как и на макрофагах) присутствуют Рц для маннозы, Рц для ЛПС, Рц TLR2 и TLR4, распознающие продукты грамотрицательных и грамположительных бактерий.
♦ На лимфоидных ДК (ДК 2) присутствуют Рц TLR7 и TLR9 (распознают вирусную и бактериальную ДНК), а также особый лектиновый Рц (связывает, например, вирус гриппа).
Иммунологический синапс. Активированные патогеном ДК мигрируют из покровных тканей в региональные лимфоидные органы (в частности, в паракортикальные зоны лимфатических узлов), где и представляют T-лимфоцитам Аг вместе с корецепторными молекулами B7.1, B7.2 и CD40. Выстраивание такого межклеточного - иммунологического - синапса (рис. 7.3) - обязательное условие начала развития иммунного ответа.
 Рис. 7.3. Иммунологический синапс между T-лимфоцитом и антигенпредставляющей клеткой.
Рис. 7.3. Иммунологический синапс между T-лимфоцитом и антигенпредставляющей клеткой.
Минимальный набор взаимодействий, необходимых для начала развития иммунного ответа: связь агрегированных TCR с комплексами пептид-MHC; связь корецептора CD4 (или CD8) с MHC; связь CD40 с CD40L; связь B7 с CD28; связи молекул адгезии (ICAM, LFA); взаимодействия цитокинов (IL) с Рц для цитокинов (ILR).
Взаимодействие T- и B-лимфоцитов
При первичном иммунном ответе единственные эффективные АПК для T-лимфоцитов - ДК. Но в случае активации T-лимфоцита Аг, представленным ДК, в иммунный ответ будут вовлекаться и рядом расположенные B-лимфоциты, которым тоже «найдётся», что распознать в сложившемся микроокружении. При этом возможны два варианта взаимодействия T- и B-лимфоцитов.
B-лимфоциты своим иммуноглобулиновым Рц связывают растворимый Аг, поглощают его эндоцитозом, подвергают внутри себя процессингу и экспонируют на поверхность фрагменты Аг в составе комплексов с молекулами MHC-II и MHC-I. TCR T- лимфоцита связывает Аг на поверхности B-лимфоцита, выступая в качестве АПК; кроме того, устанавливаются все необходимые и достаточные корецепторные взаимосвязи между T- и B-лимфоци- тами (табл. 7.2). Такое взаимодействие происходит в T-зависимых зонах периферической лимфоидной ткани в начале развития иммунного ответа.
B-лимфоцит распознаёт свой Аг, но недалеко окажется T-лимфо- цит, распознавший Аг на другой АПК и активированный взаимодействием с этой другой АПК. В таком случае T-B-взаимодействие может быть более «прохладным» и ограничиться взаимодействием цитокинов T-лимфоцита с Рц для этих цитокинов на B-лимфо-
ците, а взаимодействие мембранных молекул между ними может в какой-то мере наступать или не наступать (по крайней мере в первичном иммунном ответе). Но при вторичном иммунном ответе обязательно происходит взаимодействие мембранной молекулы B-лимфоцита CD40 с мембранной молекулой T-лимфоцита CD40L (кроме T-лимфоцитов, CD40L обнаружен пока только на тучных клетках), так как без этого взаимодействия, как показывает опыт, не происходит переключение класса иммуноглобулинов с IgM на другие, а вторичный ответ B2-лимфоцитов характеризуется обязательным переключением класса иммуноглобулинов с IgM на IgG, или IgE. Эти T-B-взаимодействия происходят уже на территории B-клеточных зон - в фолликулах лимфоидных органов.
Таблица 7.2. T-B-взаимодействие (при условии, что B-лимфоцит выполняет роль антигенпредставляющей клетки)
 факторы, определяющие иммунное отклонение
факторы, определяющие иммунное отклонение
Дендритные клетки в качестве АПК не только обеспечивают саму возможность развития лимфоцитарного иммунного ответа (или возникновение иммунологической толерантности), но и определяют направление иммунного отклонения T-лимфоцитов, а значит, и тип иммунного ответа.
Характер активации АПК зависит от биохимических характеристик и дозы патогена, его биологических свойств и путей попадания в организм. Получается следующая последовательность событий:
 *
Различные патогены по-разному связываются с разными АПК, по-разному процессируются в АПК и по-разному активируют АПК.
*
Различные патогены по-разному связываются с разными АПК, по-разному процессируются в АПК и по-разному активируют АПК.
** По-разному активированные АПК продуцируют различные цитокины, предназначенные для воздействия на T-лимфоциты. Кроме того, концентрации Аг на АПК могут значительно различаться.
*** Таким образом, и Аг, и цитокиновый сигнал со стороны АПК на T-лимфоцит определяют направление дифференцировки иммунного T-лимфоцита. **** Дифференцированные иммунные T-лимфоциты по-разному индуцируют различные варианты иммунного воспаления в тканях.
Примечания. PRR (Pattern Recognition Receptors) - Рц, распознающие молекулярную мозаику («узор») на поверхности патогена; TOLL (от имени гена Toll у Drosophila melanogaster) - Рц.
Иммунное воспаление типа I
Условия развития иммунного воспаления типа I (зависимого от Th1, CD8 + ЦТЛ). При внутриклеточных инфекциях - вирусных и ряде бактериальных - свойства патогена (в том числе его проникающая способность) таковы, что на АПК - дендритных клетках
(ДК) - создаётся высокая концентрация патогенного материала. Связывание CD40L на мембране T-лимфоцита с CD40 на ДК является для последней сигналом к продукции некоторых интерлейкинов и интерферонов. Интерлейкин-12
Миелоидные ДК продуцируют ИЛ-12 (быстро, в большом количестве, но непродолжительное время - до суток) и TNFa, стимулируя T-лимфоциты к продукции ИФНу.
Лимфоидные ДК продуцируют ИЛ-12 в меньших количествах (в 100-1000 раз), по сравнению с миелоидными ДК, зато более продолжительное время (несколько суток).
Макрофаги. ИЛ-12 продуцируют также макрофаги и нейтрофилы на стадии доиммунного воспаления.
T-лимфоцит. На T-лимфоците, TCR которого связал Аг с высокой авидностью, устойчиво экспрессируется Рц для ИЛ-12, содержащий β2-субъединицу (экспрессия этой субъединицы специфична именно для Th1).
Интерфероны
Лимфоидные ДК сразу после распознавания патогена (ещё до попадания в лимфатический узел) начинают активно продуцировать ИФН типа I (ИФНа и β), которые, с одной стороны, аутокринно стимулируют созревание ДК, с другой -индуцируют продукцию T-лимфоцитами ИФНу и ИЛ-10 (а не одного только ИФНу, как ИЛ-12 миелоидных Дк).
ИФНу и ИФНа - кофакторы для дифференцировки Th1, индуцируемой ИЛ-12. Его источником, помимо Th1, являются активированные CD8+ T-лимфоциты, т.е. лимфоциты CD8+ вносят свой вклад в дифференцировку CD4+ T-лимфоцитов в Th1.
ИЛ-10 ингибирует дифференцировку и подавляет активность Th1 (возможно, не прямо, а через подавление активности макрофагов и соответственно из-за недостатка ИЛ-12).
Таким образом, большая доза Аг и достаточные количества ИЛ-12 - два необходимых и, возможно, достаточных условия для индукции дифференцировки T-лимфоцитов в продуцентов ИФНу, т.е. CD4+ Th1.
Иммунное воспаление типа II
Условия развития иммунного воспаления типа II (Th2-зависимого).
Такой вариант иммунного ответа направлен на «перехват» растворимых компонентов патогенов (токсинов, аллергенов, химиопрепаратов), а также крупных инвазивных патогенов - гельминтов,
которые не могут быть фагоцитированы макрофагами из-за своих размеров. Растворимые патогены в низких концентрациях могут быть связаны только растворимыми же контрреагентами - АТ, поэтому в качестве АПК выступают B-лимфоциты и лимфоидные ДК. При этом внутри АПК патогены не преумножаются и экспрессируются на мембрану в комплексах Аг+MHC в малых количествах. Интерлейкин-4
Т4-лимфоциты, не получившие стимула от ИЛ-12, экспрессируют молекулу OX40. Лигандом для неё является OX40L на мембране активированных ДК и B-лимфоцитов.
Взаимодействие OX40-OX40L индуцирует продукцию в T-лимфо- ците ИЛ-4 и экспрессию на этой клетке Рц для особого хемокина blr-1, который обеспечивает миграцию данного лимфоцита на территорию лимфоидных фолликулов внутри лимфатического узла (т.е. в B-клеточную зону, где анатомически локализованы дальнейшие Т-B-взаимодействия).
Возможно, лимфоидные ДК и B-лимфоциты и сами способны к продукции ИЛ-4.
ИЛ-4 (и, возможно, его «дублёр» ИЛ-13) аутокринно стимулирует дифференцировку CD4+ T-лимфоцитов в Th2. Интерлейкин-5
При физиологически «правильном», т.е. потенциально защитном иммунном ответе на гельминтов (помимо CD4+ T-лимфоцитов - продуцентов ИЛ-4 ) дифференцируется субпопуляция CD4+ T-лимфоцитов, продуцирующих ИЛ-5.
ИЛ-5 поддерживает эозинофилопоэз и активирует зрелые эозинофилы. Это единственный известный эффекторный механизм, убивающий гельминтов, которые проникали в ткани внутренней среды организма.
Гистамин. Кишечных гельминтов организм «изгоняет» также с участием IgE, индуцирующим дегрануляцию тучных клеток в слизистой оболочке кишки. Выбрасываемый в ткани гистамин инициирует констрикцию гладких мышц стенки кишки, т.е. активную перистальтику и выброс гельминтов.
Апоптоз. Для Th2 характерна экспрессия ещё одной мембранной молекулы - CD30. Взаимодействие её с лигандом CD30L, экспрессированным на B-лимфоцитах, эозинофилах, эпителии мозговой зоны тимуса и клетках-предшественницах миелопоэза в костном мозге, сначала активирует жизнедеятельность T-лимфоцита, а затем индуцирует его апоптоз.
Чарлз Б . Карпентер (Charles В . Carpenter)
Антигены, обеспечивающие внутривидовые различия особей, обозначаются как аллоантигены, а когда они включаются в процесс отторжения аллогенных тканевых трансплантатов, то приобретают название антигенов тканевой совместимости (гистосовместимости). Эволюция закрепила единичный участок тесно сцепленных генов гистосовместимости, продукты которых на поверхности клеток обеспечивают сильный барьер при аллотрансплантации. Термины «major histocompatibility antigens» (главные антигены гистосовместимости) и «major histocompatibility gene complex» (MHC) (главный генный комплекс гистосовместимости) относятся соответственно к продуктам генов и генам этого хромосомного участка. Многочисленные минорные антигены гистосовместимости, наоборот, кодируются множественными участками генома. Им соответствуют более слабые аллоантигенные различия молекул, выполняющих разнообразные функции. Структуры, несущие детерминанты MHC, играют значительную роль в иммунитете и самораспознавании в процессе дифференцировки клеток и тканей. Информация о МНС-контроле иммунного ответа получена в опытах на животных, когда гены иммунного ответа были картированы внутри MHC-у мышей (Н-2), крыс (RT1), морских свинок (GPLA). У человека MHC назван HLA. Отдельным буквам аббревиатуры HLA придается различное значение, и с международного согласия HLA служит для обозначения человеческого МНС-комплекса.
Относительно MHC можно сделать несколько обобщений. Во-первых, в малом участке (менее 2 сантиморган) MHC кодируется три класса генных продуктов. Молекулы класса I, экспрессируемые практически всеми клетками, содержат одну тяжелую и одну легкую полипептидную цепи и являются продуктами трех редуплицированных локусов-HLA-A, HLA-B и HLA-C. Молекулы класса II, экспрессия которых ограничивается В-лимфоцитами, моноцитами и активированными Т-лимфоцитами, содержат две полипептидные цепи (aи b) неравной величины и являются продуктами нескольких тесно сцепленных генов, в сумме обозначаемых как зона HLA-D. Молекулы класса III представляют собой компоненты комплемента С4, С2 и Bf. Во-вторых, молекулы классов I и II образуют комплекс с псевдоантигеном, или антиген гистосовместимости и псевдоантиген слитно распознаются Т-лимфоцитами, имеющими соответствующий рецептор для антигена. Распознавание своего и несвоего при запуске и в эффекторной фазе иммунного ответа непосредственно направляется молекулами I и II классов. В-третьих, четких ограничений межклеточных взаимодействий, в которых участвуют супрессорные Т-лимфоциты, у человека не выявлено, но роль генов HLA достаточно важна для некоторых проявлений супрессорной Т-клеточной активности. В-четвертых, в МНС-регионе локализуются гены ферментных систем, не имеющих непосредственного отношения к иммунитету, но важных для роста и развития скелета. Известные локусы HLA на коротком плече 6-й хромосомы представлены на 63-1.
Локусы системы HLA. Антигены класса I. HLA-антигены I класса определяются серологически с помощью человеческих сывороток, главным образом от многорожавших женщин, и в меньшей степени с помощью моноклональных антител. Антигены I класса путствуют с разной плотностью во многих тканях организма, включая В-клетки, Т-клетки, тромбоциты, но не на зрелых эритроцитах. Количество серологически выявляемых специфичностей велико, и система HLA является наиболее полиморфной из известных генетических систем человека. Внутри HLA-комплекса для серологически выявимых HLA антигенов I класса четко определяются три локуса. Каждый антиген 1 класса содержит b 2 -микроглобулиновую субъединицу (мол. масса 11500) и тяжелую цепь (мол. масса 44000), несущую антигенную специфичность (63-2). Существует 70 четко определенных А- и В-специфичностей и восемь специфичностей локуса С. Обозначение HLA обычно путствует в наименовании антигенов главного комплекса гистосовместимости, но может не употребляться, когда позволяет контекст. Антигены, неокончательно классифицированные ВОЗ, имеют в обозначении букву w после названия локуса. Номер, следующий за обозначением локуса, служит собственным названием антигена. HLA-антигены населения Африки, Азии и Океании в настоящее время недостаточно четко определены, хотя они включают часть общих антигенов, свойственных лицам западноевропейского происхождения. Распределение HLA-антигенов различно в разных расовых группах, и они могут быть использованы как антропологические маркеры в изучении заболеваний и миграционных процессов.
63-1. Схематическое изображение хромосомы 6.
Показана локализация зоны HLA в регионе 21 короткого плеча. Локусы HLA-A, HLA-B и HLA-C кодируют тяжелые цепи класса I (44000), тогда как b 2 -микроглобулиновая легкая цепь (11500) молекул класса I кодируется геном хромосомы 15. Зона HLA-D (класс II) расположена центромерно по отношению к локусам А, В и С с тесно сцепленными генами компонентов комплемента С4А, С4В, Bf и С2 на участке B-D. Порядок расположения генов комплемента не установлен. Каждая молекула класса II D-региона образована a- и b-цепями. Они путствуют на клеточной поверхности в разных участках (DP, DQ и DR). Цифра, предшествующая знакам aи b, означает, что существуют различные гены для цепей данного типа, например, для DR существует три гена b-цепей, так что экспрессируемые молекулы могут быть 1ba, 2baили 3ba. Антигены DRw52(MT2) и DRw53(MT3) находятся на 2b-цепи, тогда как DR - на lb-цепи. DR неполиморфен, а молекулы DQ-антигенов полиморфны как по a-, так и по b-цепям (2a2b). Другие типы DQ (1a1b) имеют ограниченный полиморфизм. Полиморфизм DP связан с b-цепями. Общая протяженность HLA-региона- около 3 сМ.
Поскольку хромосомы парны, каждый индивид имеет до шести серологически определимых антигенов HLA-A, HLA-B и HLA-C, по три от каждого из родителей. Каждый из этих наборов обозначается как гаплотип, и в соответствии с простым менделевским наследованием четвертая часть потомства имеет идентичные гаплотипы, половина - часть общих гаплотипов и оставшаяся четверть - полностью несовместима (63-3). Значение роли этого генного комплекса в трансплантационном ответе подтверждается тем, что подбор по гаплотипу пар донор - реципиент среди потомства одного поколения обеспечивает наилучшие результаты при трансплантации почек - около 85-90% длительного выживания (гл. 221).
Антигены класса II. Зона HLA-D примыкает к локусам класса I на коротком плече 6-й хромосомы (63-1). Этот регион кодирует серию молекул класса II, каждая из которых содержит a-цепь (мол, масса 29000) и b-цепь (мол. масса 34000) (63-2). Несовместимость по этому региону, особенно по антигенам DR, определяет пролиферативную реакцию лимфоцитов in vitro. Смешанная лимфоцитарная реакция (MLR) оценивается по уровню пролиферации в смешанной культуре лимфоцитов (MLC) и может быть положительной даже при идентичности по антигенам HLA-A, HLA-B и HLA-C (63-3). Антигены HLA-D определяются с помощью стандартных стимулирующих лимфоцитов, гомозиготных по HLA-D и инактивированных рентгеновскими лучами или митомицином С с целью придания реакции однонаправленности. Существует 19 таких антигенов (HLA-Dwl-19), обнаруженных с использованием гомозиготных типирующих клеток.
Попытки определения HLA-D серологическими методами сначала позволили обнаружить серию D-связанных (DR) антигенов, экспрессированных на молекулах класса II В-лимфоцнтов, моноцитов и активированных Т-лимфоцитов. Затем были описаны и другие тесно сцепленные антигенные системы, которые получили различные наименования (MB, MT, DC, SB). Идентичность отдельных групп молекул класса II сейчас установлена, и гены соответствующих a - и b-цепей выделены и секвенированы. Генная карта класса II, представленная на 63-1, отражает минимальное число генов и молекулярных участков. Хотя молекула масса II может содержать DRaиз гаплотипа одного из родителей, a DRb- другого (транскомплементация), комбинаторика вне каждого из участков DP, DQ, DR редка, если вообще возможна. Молекулы DR и в определенной степени DQ могут служить стимулами для первичной MLR. Вторичная MLR определяется как тест с примированными лимфоцитами (PLT) и дает возможность получить результат через 24-36 ч вместо 6-7 дней для первичной реакции. Аллоантигены DP были открыты благодаря их способности вызывать стимуляцию PLT, хотя они не дают первичной MLR. Хотя В-лимфоциты и активированные Т-лимфоциты экспрессируют все три набора молекул класса II, антигены DQ не экспрессируются на 60-90% DP- и DR-позитивных моноцитов.
63-2. Схематическое изображение молекул клеточной поверхности классов I и II.
Молекулы класса I состоят из двух полипептидных цепей. Тяжелая цепь с мол. массой 44 000 проходит сквозь плазматическую мембрану; ее наружный участок состоит из трех доменов (a 1 , a 2 и a 3), формируемых дисульфидными связями. Легкая цепь с мол. массой 11500 (b 2 -микроглобулин, b2мю) кодируется хромосомой 15 и нековалентно связана с тяжелой цепью. Аминокислотная гомология между молекулами I класса составляет 80-85%, снижаясь до 50% в участках a 1 и a 2 , которые, вероятно, соответствуют участкам аллоантигенного полиморфизма. Молекулы класса II образованы двумя нековалентно связанными полипсптидными цепями, a-цепь с мол. массой 34000 и b-цепь с мол массой 29000. Каждая цепь содержит два домена, сформированных дисульфидными связями (из С. Б. Carpenter, E. L. Milford, Renal Transplantation: Immunobiology in the Kidnev/Eds. B. Brenner, F. Rector, New York: Samiders, 1985).
63-3. HLA-зона хромосомы 6: наследование HLA-гаплотипов. Каждый хромосомный сегмент сцепленных генов обозначается как гаплотип, и каждый индивид наследует по одному гаплотипу от каждого родителя. На диаграмме представлены антигены А, В и С гаплотипов а и b для данного гипотетического индивида; ниже раскрыты обозначения гаплотипов в соответствии с текстом. Если мужчина с гаплотипом ab женится на женщине с гаплотипом cd, потомки могут быть только четырех типов (с точки зрения HLA). Если в мейозе у одного из родителей происходит рекомбинация (отмечена прерывистыми линиями), то это приводит к формированию измененного гап-лотнпа. Частота измененных гаплотипов у детей служит мерой расстояний на генетической карге (1% частота рекомбинаций== 1 сМ; 63-1) (из Г.. В. Carpenter. Kidney International, Г)78. 14. 283).
Молекулярная генетика. Каждая полипептидная цепь молекул классов I и II содержит несколько полиморфных участков в дополнение к «частной» антигенной детерминанте, определяемой с помощью антисывороток. В тесте клеточно-опосредованного лимфолиза (CML) определяется специфичность киллерных Т-клеток (Тк), которые возникают в процессе пролиферации при MLR, путем тестирования на клетках-мишенях от доноров, не служивших источником стимулирующих клеток для MLR. Антигенные системы, определяемые этим методом, обнаруживают тесную, но неполную корреляцию с «частными» антигенами класса 1. Клонирование циготоксических клеток позволило обнаружить набор полиморфных детерминант-мишеней на молекулах HLA, некоторые из которых невозможно выявить с помощью аллоантисывороток и моноклональных антител, полученных иммунизацией мышей человеческими клетками. Некоторые из этих реагентов могут быть использованы для идентификации «частных» детерминант HLA, в то время как другие направлены к более «общим» (иногда называемым супертипируемыми) детерминантам. Одна такая система «общих» HLA-B антигенов имеет два аллеля, Bw4 и Bw6. Большинство «частных» HLA-B связаны или с Bw4, или с Bw6. Другие системы сопряжены с подгруппами HLA антигенов. Например, HLA-B-позитивные тяжелые цепи содержат дополнительные участки, общие для В7, В27, Bw22 и В40 или для В5, В15, В18 и Bw35. Существуют и другие типы перекрывающихся антигенных детерминант, о чем свидетельствует реакция моноклональных антител с участком, общим для тяжелых цепей HLA-A и HLA-B. Изучение аминокислотной последовательности и псптидных карт некоторых молекул HLA показало, что гипервариабельные участки антигенов класса I сосредоточены в наружном a 1 -домене (63-2) и прилегающем участке a 2 -домена. Вариабельные последовательности молекул класса II различны для разных локусов. Замечательно, что a 3 -домен класса I, a 2 -домен класса II и b 2 -домен, а также часть мембранной молекулы Т8 (Leu 2), участвующей в межклеточных взаимодействиях (гл. 62), обнаруживают значительную гомологию последовательности аминокислот с константными зонами иммуноглобулинов. Это подтверждает гипотезу об эволюционном формировании семейства генных продуктов, которые несут функции иммунологичсского распознавания. При исследовании геномной ДНК HLA для молекул классов I и II были обнаружены типичные экзон-интронные последовательности, причем экзоны были идентифицированы для сигнальных пептидов (5) каждого из доменов, трансмембранного гидрофобного сегмента и цитоплазматического сегмента (З). Имеются пробы кДНК для большинства цепей HLA, а применение ферментативных гидролизатов для оценки состояния полиморфизма рестрикционных фрагментов по длине (ПДРФ), позволило получить данные, которые коррелируют с результатами изучения молекул класса 11 серологическими методами в MLR. Однако многочисленность (20-30) генов класса 1 делает оценку полиморфизма по ПДРФ затруднительной. Многие из этих генов не экспрессируются (псевдогены), хотя некоторые могут соответствовать дополнительным локусам класса I, которые экспрессируются только на активированных Т-клетках; функции их неизвестны. Разработка специфических проб на локусы HLA-A и HLA-B поможет разобраться в этой достаточно сложной проблеме.
Комплемент (класс III). Структурные гены трех компонентов комплемента-С4, С2 и Bf-путствуют в зоне HLA-B-D (63-1). Это два локуса С4, кодирующие С4А и С4В, первоначально описанные как эритроцитарные антигены Rodgers и Chido соответственно. Эти антигены оказались в действительности абсорбированными из плазмы молекулами С4. Другие компоненты комплемента не имеют тесного сцепления с HLA. Между генами С2, Bf и С4 кроссинговера не описано. Все они кодируются участком между HLA-B и HLA-DR длиной около 100ко. Существуют два аллеля С2, четыре Bf, семь С4А и три С4В, кроме того, в каждом локусе имеются молчащие аллели QO. Исключительная полиморфность гистотипов комплемента (комплотипы) делает эту систему пригодной для генетических исследований.
Таблица 63-1. Наиболее распространенные гаплотины HLA
В табл. 63-1 представлены четыре наиболее широко распространенных гаплотипа, обнаруженных у лиц западноевропейского происхождения. Результаты MLR у людей, не состоящих в родстве, отобранных по признаку совместимости по этим гаплотипам, отрицательны, в то же время реакция обычно имеет место, если неродственные индивиды подобраны только на совместимость по HLA-DR и DQ. Такие идентичные распространенные гаплотипы, возможно, в неизменном виде происходят от единого предка.
Другие гены 6-й хромосомы. Недостаточность стероид 21-гидроксилазы, аутосомно-рецессивный признак, вызывает синдром врожденной гиперплазии надпочечников (гл. 325 и 333). Ген для этого фермента локализуется на участке HLA-B-D. Ген 21-гидроксилазы, прилегающий к гену С4А, делетирован у лиц, страдающих упомянутым синдромом, вместе с С4А (C4AQO), и ген HLA-B может трансформироваться с конверсией В 13 в редкий Bw47, обнаруживаемый только в измененных гаплотипах. В отличие от поздно проявляющегося дефицита 21-гидроксилазы, сцепленного с HLA, врожденная гиперплазия надпочечников, связанная с дефицитом 21b-гидроксилазы, не сцеплена с HLA. В нескольких семейных исследованиях показано, что идиопатический гемохроматоз, аутосомно-рецессивное заболевание, сцеплено с HLA (гл. 310). Хотя патогенез расстройств всасывания железа в желудочно-кишечном тракте неизвестен, установлено, что гены, модулирующие этот процесс, находятся вблизи участка HLA-A.
| Таблица 63-2. Сцепление генетических дефектов | ||
| Локализация | Обнаруживаемые |
|
| гаплотипы |
||
| Дефицит С2 | Aw25, B18, BfS, DR2 |
|
| Дефицит 21-ОН | A3, Bw47, BfF, DR7 |
|
| Дефицит 21-ОН (позднее проявление) | ||
| Идиопатический гемохроматоз | ||
| Болезнь Педжета | ||
| Спинно-мозжечковая атаксия | ||
| Болезнь Ходжкина | ||
63-4. Схема относительной роли HLA-A, HLA-B, HLA-C и HLA-D антигенов в инициации аллоиммунного ответа и в образовании эффекторных клеток и антител.
Два главных класса Т-лимфоцитов распознают антигены: Тк - предшественники цитотоксических «киллерных» клеток и Тх-хелперные клетки, способствующие развитию цитотоксического ответа. Тх также обеспечивают помощь В-лимфоцитам при развитии «зрелого» IgG-ответа. Важно отметить, что Тк обычно распознают антигены класса I, тогда как сигнал для Тх создает преимущественно HLA-D, который тесно связан с антигенами класса II (из С. В. Carpenter.- Kidney International, 1978, 14, 283).
Гены иммунного ответа. При изучении in vitro ответа на синтетические полипептидные антигены, гемоцианин, коллаген, столбнячный токсоид выявлено, что зона HLA-D аналогична региону Н-2. I у мыши. Презентация антигенных фрагментов на поверхности макрофагов или других клеток, несущих молекулы II класса, требует сопряженного распознавания комплекса «молекула II класса + антиген» Т-лимфоцитами, несущими соответствующий рецептор (ы) (гл. 62). Стержнем этой гипотезы «свое-)-Х» или «измененное свое» состоит в том, что Т-зависимый иммунный ответ, действие Т-хелперов/индукторов (Тх) осуществляется только в том случае, если будут синтезированы соответствующие детерминанты класса II. Гены последних и есть Ir-гены. Поскольку аллогенные детерминанты класса И распознаются как уже измененные, аллогенная MLP представляет собой модель иммунной системы, в которой путствие псевдоантигена необязательно (63-4). Эффекторные фазы иммунитета требуют распознавания псевдоантигена в комплексе с собственными структурами. Последние у человека, как и у мыши, представляют собой молекулы антигенов гистосовместимости I класса. Человеческие клеточные линии, инфицированные вирусом гриппа, лизируются иммунными цитотоксическими Т-лимфоцитами (Тк) только в том случае, если реагирующие клетки и клетки-мишени идентичны по локусам HLA-A и HLA-B. Аллогенная MLR служит моделью и для формирования цитотоксических Т-лимфоцитов, рестриктированных по классу I (63-4). Детали рестрикции по различным молекулам классов I и II и эпитопам могут быть вычленены при использовании примированных клеток, подвергшихся размножению и клонированию. Например, на уровне антигенпрезентирующих клеток данный Тх-клон распознает антигенный фрагмент, комплексированный со специфическим участком молекулы класса II, с помощью рецептора Ti. Рестриктирующими элементами.для некоторых микробных антигенов являются аллели DR и Dw.
Супрессия иммунного ответа (или, низкий уровень отвечаемости) к пыльце кедра, антигенам стрептококков и шистосом доминантна и сцеплена с HLA, что свидетельствует о существовании генов иммунной супрессии (Is). Показано также наличие специфических аллельных ассоциаций HLA с уровнем иммунного ответа, например, для антигена клещевины Ra5 - с DR2 и для коллагена - с DR4.
Ассоциации с болезнями. Если главный комплекс гистосовместимости выполняет важную биологическую функцию, то какова эта функция? Одна из гипотез состоит в том что он играет роль в иммунном надзоре за неопластическими клетками, появляющимися в течение жизни индивида. Велико значение этой системы при беременности, поскольку между матерью и плодом всегда существует тканевая несовместимость. Высокая степень полиморфизма может также способствовать выживаемости видов в противостоянии огромному числу микробных агентов путствующих в окружающей среде. Толерантность к «своему» (аутотолерантность) может перекрестие распространяться на микробные антигены, следствием которой будет высокая восприимчивость, приводящая к возникновению смертельных инфекций, в то время как полиморфизм по системе HLA способствует тому что часть популяции распознает опасные агенты как чужеродные и включает адекватную ответную реакцию. Эти гипотезы связывают роль HLA с преимуществами, благодаря которым система выживает в условиях давления отбора Каждая из этих гипотез имеет определенные подтверждения.
Важным свидетельством роли комплекса HLA в иммунобиологии послужило обнаружение положительной ассоциации некоторых патологических процессов с антигенами HLA. Изучение этих ассоциаций было стимулировано открытием генов иммунного ответа, сцепленных с Н-2-комплексом, у мышеи. В табл. 63-3 суммированы наиболее значимые ассоциации HLA и болезней.
Установлено что частота встречаемости HLA-B27 повышается при некоторых ревматических заболеваниях, особенно при анкилозирующем спондилите, заболевании явно семейного характера. Антиген В27 имеется лишь у 7% лиц западноевропейского происхождения, но его обнаруживают у 80-90% больных анкилозирующим спондилитом. В пересчете на относительный к это означает, что этот антиген ответствен за восприимчивость к развитию анкилозирующего спондилита, которая в 87 раз выше у его носителей, чем в общей популяции. Аналогично показана высокая степень ассоциации с антигеном В27 острого переднего увеита, синдрома Рейтера и реактивных артритов по крайней мере при трех бактериальных инфекциях (иерсиниозе, сальмонеллезе и гонорее). Хотя обычная форма ювенильного ревматоидного артрита также ассоциирована с В27, тип заболевания со слабо выраженным суставным синдромом и иритом связан с В27. При псориатическом артрите центрального типа чаще встречается В27, тогда как Bw38 ассоциирован как с центральным, так и с периферическим типами. Псориаз ассоциирован с Cw6. У больных с дегенеративным артритом или подагрой не обнаруживается каких-либо изменений в частоте встречаемости антигенов.
Большинство других ассоциаций с болезнями свойственно антигенам HLA-D-зоны Например, глютенчувствительная энтеропатия у детей и взрослых ассоциирована с антигеном DR3 (относительный к 21) Действительный процент больных с данным антигеном варьирует от 63 до 96% в сравнении с 22-27% в контроле. Тот же антиген чаще обнаруживается у больных с активным хроническим гепатитом и герпетиформным дерматитом, страдающих в то же время и глютенчувствительной энтеропатией. Ювенильный инсулинзависимыи сахарный диабет (тип I) ассоциирован с DR3 и DR4 и отрицательно ассоциирован с DR2 У 17-25% больных диабетом I типа обнаружен редкий аллель Bf (М). Диабет с началом во взрослом периоде жизни (типа II) не имеет ассоциации с HLA. Гипертиреоидизм в США ассоциирован с В8 и Dw3, в то время как в японской популяции - с Bw35. Более широкое обследование здоровых и больных представителей различных рас поможет прояснить вопрос об универсальных HLA-маркерах. Например, антиген В27, редкий у здоровых лиц японской национальности, обычен у больных с анкилозирующим спондилитом. Точно так же DR4 - маркер тля диабетаI типа у представителей всех рас. Иногда HLA-маркер явно ассоциирован только с частью симптомов внутри синдрома. Например, миастения значительно сильнее ассоциирована с антигенами В8 и DR3 у больных без тимомы, а рассеянный склероз - с антигеном DR2 у лиц с быстро прогрессирующим течением болезни. Синдром Гудпасчера, связанный с аутоиммунным поражением клубочковых базальных мембран, идиопатический мембранозный гломерулонефрит, отражающий аутоиммунные процессы с образованием антител к антигенам клубочков, а также мембранозный нефрит, индуцированный золотом, в значительной степени ассоциированы с HLA-DR.
Таблица 63-3. Заболевания, ассоциированные с HLA-антигенами
| Заболевания | Относительный к | |||
| Ревматоидные | ||||
| Анкилозирующий спондилит | ||||
| Синдром Рейтера | ||||
| Острый передний увеит | ||||
| Реактивный артрит (Yersinia, Salmonella, Gonococcus) | ||||
| Псориатический артрит (центральный) | ||||
| Псориатический артрит (периферический) | ||||
| Ювенильный ревматоидный артрит | ||||
| Ювенильный артрит со слабо выраженным суставным синдромом | ||||
| Ревматоидный артрит | ||||
| Синдром Шегрена | ||||
| Системная красная волчанка | ||||
| Системная красная волчанка (в результате | ||||
| приема апрессина) | ||||
| Желудочно-кишечные | ||||
| Глютенчувствительная энтеропатия | ||||
| Хронический активный гепатит | ||||
| Язвенный колит | ||||
| Гематологические | ||||
| Идиопатический гемохроматоз | ||||
| Пернициозная анемия | ||||
| Герпетиформный дерматит | ||||
| Псориаз вульгарный | ||||
| Псориаз вульгарный (в японской популяции) | ||||
| Пузырчатка вульгарная (в европейской попу ляции) | ||||
| Болезнь Бехчета | ||||
| Эндокринные | ||||
| Сахарный диабет I типа | ||||
| Гипертиреоидизм | ||||
| Гинертиреоидизм (в японской популяции) | ||||
| Заболевания | Наиболее тесно ассоциированные антигены | Относительный к |
||
| Недостаточность надпочечников | ||||
| Подострый тиреоидит (de Quervain) | ||||
| Тиреоидит Хашимото | ||||
| Н еврологические | ||||
| Миастения | ||||
| Рассеянный склероз | ||||
| Маниакально-депрессивное расстройство | ||||
| Шизофрения | ||||
| Почечные | ||||
| Идиопатический мембранозный гломеруло- | ||||
| Болезнь Гудпасчера (анти-GMB) | ||||
| Болезнь минимальных изменений (стероидный | ||||
| Полицистозная болезнь почек | ||||
| IgA-нефропатия | ||||
| Нефропатия, вызванная золотом | ||||
| Инфекционные | ||||
| Туберкулоидная лепра (в азиатской попу | ||||
| Полнопаралич | ||||
| Низкий ответ на вирус вакцины | ||||
| Иммунодефицитные | ||||
| Дефицит IgA (доноры крови) | ||||
Неравновесное сцепление. Хотя распределение аллелей HLA варьирует в расовых и этнических популяциях, наиболее характерную особенность популяционной генетики антигенов HLA представляет наличие неравновесного сцепления для некоторых антигенов А и В, В и С, В, D и локусов комплемента. Неравновесность сцепления означает, что антигены тесно сцепленных локусов оказываются вместе чаще, чем следует из предположения о случайной ассоциации. Классическим примером неравновесного сцепления является связь антигена локуса AHLA-A1 с антигеном локуса В HLA-B8 у лиц западноевропейского происхождения. Одновременное наличие А1 и В8, рассчитанное на основе частот их генов, должно наблюдаться с частотой 0,17. 0,11, т. е. примерно 0,02. Тогда как наблюдаемая частота их сосуществования составляет 0,08, т. е. в 4 раза больше, чем ожидаемая, и разность между этими величинами составляет 0,06. Последняя величина обозначается дельта (D) и служит мерой неравновесности. Обнаружено неравновесное сцепление и других гаплотипов А- и В-локусов: A3 и В7, А2 и В 12, А29 и В 12, A11 и Bw35, Для некоторых детерминант D-зоны описано неравновесное сцепление с антигенами В-локуса (например, DR3 и В8); а также для антигенов В- и С-локусов. Серологически выявляемые антигены HLA служат маркерами для генов целого гаплотипа внутри семейства и маркерами специфических генов в популяции, но только при наличии неравновесного сцепления.
Значение неравновесного сцепления велико, поскольку такие генные ассоциации могут порождать определенные функции. Давление отбора в процессе эволюции может быть основным фактором в сохранении некоторых генных комбинаций в генотипах. Так, например, существует теория, согласно которой А1 и В8, а также некоторые детерминанты D и других регионов обеспечивают селективное преимущество перед лицом эпидемий таких болезней, как чума или оспа. Однако возможно также, что потомки людей, выживших во время подобных эпидемий, сохраняют восприимчивость к иным болезням, поскольку их уникальный генный комплекс не обеспечивает адекватный ответ на другие факторы окружающей среды. Главная трудность этой гипотезы состоит в допущении, что отбор действует на несколько генов одновременно и обеспечивает тем самым возникновение наблюдаемых значений Л, однако потребность в сложных взаимодействиях между продуктами разных локусов МНС-комплекса - лишь начальное звено для наблюдаемых явлений и селекция может усилить множественное неравновесное сцепление. Сохранение некоторых распространенных гаплотипов, названных выше, поддерживает этот взгляд.
С другой стороны, гипотеза отбора необязательно должна объяснять неравновесное сцепление. Когда популяция, лишенная некоторых антигенов, скрещивается с другой, для которой характерна высокая частота этих антигенов, находящихся в равновесии, Dможет проявиться через несколько поколений. Например, нарастание Dдля А1 и В8, обнаруженное в популяциях в направлении с востока на запад, от Индии к Западной Европе, может быть объяснено на основе миграции и ассимиляции населения. В малых группах неравновесность может быть обусловлена совместимостью, эффектом основателей и дрейфом генов. Наконец, некоторые случаи неравновесного сцепления являются результатом неслучайного кроссинговера во время мейоза, так как хромосомные сегменты могут быть в большей или меньшей степени ломкими. Будь то давление отбора или ограничения кроссинговера, неравновесность сцепления может исчезать в течение нескольких поколений. Большое число неслучайных ассоциаций имеется в HLA-генном комплексе и определение их причин может обеспечить проникновение в механизмы, лежащие в основе чувствительности к болезням.
Сцепление и ассоциации. В табл. 63-2 перечислены болезни, служащие примером сцепления с HLA, когда наследственные признаки маркируются в пределах семьи соответствующими гаплотипами. Например, дефицит С2, 21-гидроксилазы, идиопатический гемохроматоз наследуются по рецессивному типу с наличием часгичного дефицита у гетерозигот. Эти генетические нарушения также являются HLA-ассоциированными и обусловливаются избытком некоторых HLA-аллелей у больных людей, не состоящих в родстве. Дефицит С2 обычно сцеплен с гаплотипами HLA-Aw 25, В 18, В55, D/DR2, а при идиопатическом гемохроматозе проявляется как сцепление, так и сильная ассоциация между HLA-A3 и В 14. Высокая степень неравновесного сцепления в этом случае вызвана мутациями у лица, послужившего его источником; кроме того, недостаточен был период времени, необходимый для возвращения пула генов в состояние равновесия. С этой точки зрения HLA-гены - простые маркеры сцепленных генов. С другой стороны, для проявления конкретного нарушения может требоваться взаимодействие со специфическими HLA-аллелями. Последняя гипотеза потребовала бы признания более высокого темпа мутаций с экспрессией дефектных генов, что происходит только при условии сцепления с некоторыми HLA-генами.
Болезнь Педжета и спинно-мозжечковая атаксия являются HLA-сцепленными аутосомно-доминантными наследственными заболеваниями; они обнаруживаются сразу у нескольких членов семьи. Болезнь Ходжкина служит проявлением HLA-сцепленного рецессивного наследственного дефекта. Никаких HLA-ассоциаций не было обнаружено при этих заболеваниях, что свидетельствует в пользу исходной множественности «основоположников» этих болезней с мутациями, связанными с различными аллелями HLA.
Сцепление с HLA без труда определяется, когда доминантность и рецессивность признаков легко разграничить, т. е. когда высока экспрессивность и процесс детерминируется дефектом единичных генов. При большинстве ассоциаций HLA-маркеры отражают факторы ка, вовлекаемые в реализацию и модуляцию иммунного ответа под влиянием множественных генов. Примером полигенного иммунного заболевания является атоническая аллергия, при которой ассоциация с HLA может быть очевидной только у лиц с низким генетически контролируемым (не в связи с HLA) уровнем продукции IgE. Другой пример такого рода - дефицит IgA (табл. 63-3), ассоциированный с HLA-DR3.
Клиническое значение системы HLA. Клиническое значение типирования HLA для диагностики ограничивается определением В27 при диагностике анкилозирующего спондилита; тем не менее и в этом случае наблюдается 10% ложноположительных и ложноотрицательных результатов. Изучение HLA имеет ценность также в практике генетических консультаций для раннего определения болезней в семьях с идиопатическим гемохроматозом, врожденной гиперплазией надпочечников, связанной с дефицитом стероидгидроксилазы, в особенности если HLA-типирование осуществляется на клетках, полученных амниоцентезом. Высокая степень полиморфизма в системе HLA делает ее ценным инструментом для тестирования различных клеточных препаратов, в особенности в судебно-медицинской практике. Некоторые болезни, такие как сахарный диабет I типа и другие, для которых показаны HLA-ассоциации, требуют дополнительного изучения роли компонентов системы HLA в патогенезе этих заболеваний.